目录
基本信息
- Stein-Leventhal综合征
- polycystic ovarian syndrome,PCOS
- 妇产科
- 卵巢
- 可能与一些基因在特定环境因素的作用下导致疾病发生有关
- 闭经、多毛、不孕、肥胖
- 无
目前对于PCOS病因学研究有非遗传理论和遗传理论两种。
1.PCOS非遗传学理论
研究认为孕期子宫内激素环境影响成年后个体的内分泌状态,孕期暴露于高浓度雄激素环境下,如母亲PCOS史、母亲为先天性肾上腺皮质增生症高雄激素控制不良等,青春期后易发生排卵功能障碍。
2.PCOS遗传学理论
此理论的主要根据PCOS呈家族群居现象,家族性排卵功能障碍和卵巢多囊样改变提示该病存在遗传基础。高雄激素血症和(或)高胰岛素血症可能是PCOS家族成员同样患病的遗传特征,胰岛素促进卵巢雄激素生成作用亦受遗传因素或遗传易感性影响。稀发排卵、高雄激素血症和卵巢多囊样改变的家族成员中女性发生高胰岛素血症和男性过早脱发的患病率增高。细胞遗传学研究结果显示PCOS可能为X连锁隐性遗传、常染色体显性遗传或多基因遗传方式。通过全基因组扫描的发现最大量的与PCOS相关的遗传基因,如甾体激素合成及相关功能的候选基因、雄激素合成相关调节基因、胰岛素合成相关基因、碳水化合物代谢及能量平衡的候选基因、促性腺激素功能及调节的候选基因、脂肪组织相关的基因以及慢性炎症相关基因。
总之,PCOS病因学研究无法证实此病是由某个基因位点或某个基因突变所导致,其发病可能与一些基因在特定环境因素的作用下发生作用导致疾病发生有关。
根据PCOS国际诊断标准(详见诊断部分)诊断的PCOS可以进行亚型分型,以便于个体化治疗选择:
1型:经典PCOS,超声卵巢多囊样改变及高雄激素的临床表现和/或高雄激素血症;
2型:超声卵巢多囊样改变及稀发排卵或无排卵;
3型:NIH标准PCOS,高雄激素的临床表现和/或高雄激素血症及稀发排卵或无排卵;
4型:同时具备超声卵巢多囊样改变、高雄激素的临床表现和/或高雄激素血症及稀发排卵或无排卵,此型也被称为经典PCOS。
1.月经紊乱
PCOS导致患者无排卵或稀发排卵,约70%伴有月经紊乱,主要的临床表现形式为闭经、月经稀发和功血,占月经异常妇女70%~80%,占继发性闭经的30%,占无排卵型功血的85%。由于PCOS患者排卵功能障碍,缺乏周期性孕激素分泌,子宫内膜长期处于单纯高雌激素刺激下,内膜持续增生易发生子宫内膜单纯性增生、异常性增生,甚至子宫内膜非典型增生和子宫内膜癌。
2.高雄激素相关临床表现
(1)多毛 毛发的多少和分布因性别和种族的不同而有差异,多毛是雄激素增高的重要表现之一,临床上评定多毛的方法很多,其中世界卫生组织推荐的评定方法是Ferriman-Gallway毛发评分标准。我国PCOS患者多毛现象多不严重,大规模社区人群流调结果显示mFG评分>5分可以诊断多毛,过多的性毛主要分布在上唇、下腹和大腿内侧。
(2)高雄激素性痤疮 PCOS患者多为成年女性痤疮,伴有皮肤粗糙、毛孔粗大,与青春期痤疮不同,具有症状重、持续时间长、顽固难愈、治疗反应差的特点。
(3)女性型脱发(FPA) PCOS20岁左右即开始脱发。主要发生在头顶部,向前可延伸到前头部(但不侵犯发际),向后可延伸到后头部(但不侵犯后枕部),只是头顶部毛发弥散性稀少、脱落,它既不侵犯发际线,也不会发生光头。
(4)皮脂溢出 PCOS产生过量的雄激素,发生高雄激素血症,使皮脂分泌增加,导致患者头面部油脂过多,毛孔增大,鼻唇沟两侧皮肤稍发红、油腻,头皮鳞屑多、头皮痒,胸、背部油脂分泌也增多。
(5)男性化表现 主要表现为有男性型阴毛分布,一般不出现明显男性化表现,如阴蒂肥大、乳腺萎缩、声音低沉及其他外生殖器发育异常。在PCOS患者如有典型男性化表现应注意鉴别先天性肾上腺皮质增生、肾上腺肿瘤及分泌雄激素的肿瘤等。
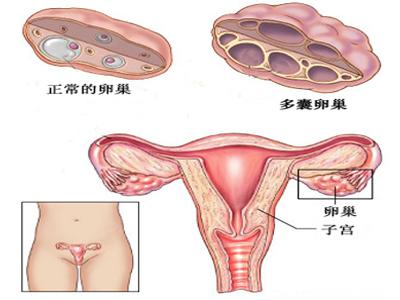
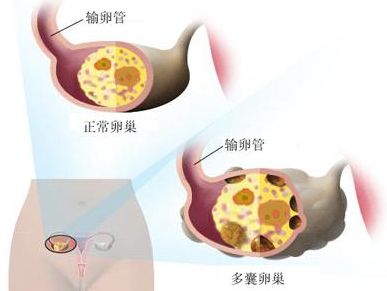
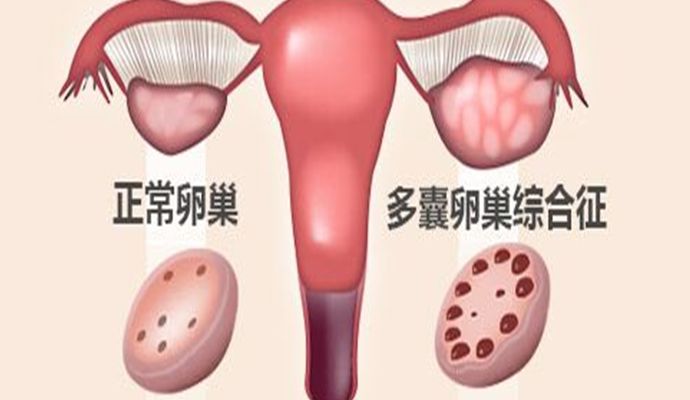
3.卵巢多囊样改变(PCO)
关于PCO的超声诊断标准虽然进行了大量的研究,但仍众说纷纭,加上人种的差异,其诊断标准的统一更加困难。2003年鹿特丹的PCO超声标准是单侧或双侧卵巢内卵泡≥12个,直径在2~9mm,和/或卵巢体积(长×宽×厚/2)>10ml。同时可表现为髓质回声增强。
4.其他
(1)肥胖 肥胖占PCOS患者的30%~60%,其发生率因种族和饮食习惯不同而不同。在美国,50%的PCOS妇女存在超重或肥胖,而其他国家的报道中肥胖型PCOS相对要少的多。PCOS的肥胖表现为向心性肥胖(也称腹型肥胖),甚至非肥胖的PCOS患者也表现为血管周围或网膜脂肪分布比例增加。
(2)不孕 由于排卵功能障碍使PCOS患者受孕率降低,且流产率增高,但PCOS患者的流产率是否增加或流产是否为超重的结果目前还不清楚。
(3)阻塞性睡眠窒息 这种问题在PCOS患者中常见,且不能单纯用肥胖解释,胰岛素抵抗较年龄、BMI或循环睾酮水平对睡眠中呼吸困难的预测作用更大。
(4)抑郁 PCOS患者抑郁发病率增加,且与高体质指数和胰岛素抵抗有关,患者生活质量和性满意度明显下降。
1935年,Stein和Leventha首次报告此病后被定名为Stein-Leventhal综合征(S-L征)。1960年由于患者以双侧卵巢囊性增大为特征,故改称为多囊卵巢综合征(PCOS)。由于PCOS有高度临床异质性,病因及发病机制至今不清,到2003年欧洲人类生殖和胚胎与美国生殖医学学会的(ESHRE/ASRM)的专家召开PCOS国际协作组专家会议制定了PCOS的国际诊断标准,具体诊断标准如下:
1.稀发排卵或无排卵;
2.高雄激素的临床表现和/或高雄激素血症;
3.超声表现为多囊卵巢(一侧或双侧卵巢有12个以上直径为2~9mm的卵泡,和/或卵巢体积大于10ml);
上述3条中符合2条,并排除其他疾病如先天性肾上腺皮质增生、库欣综合征、分泌雄激素的肿瘤。
为制定中国PCOS的诊治规范,中华医学会妇产科学分会内分泌学组于2006年在重庆讨论并初步制定了目前中国的PCOS诊断、治疗专家共识。2007年出台了目前中国的PCOS诊断和治疗专家共识,专家建议在现阶段推荐采用2003年鹿特丹PCOS国际诊断标准。即稀发排卵或无排卵;高雄激素的临床表现和/或高雄激素血症;卵巢多囊性改变:一侧或双侧卵巢直径2~9mm的卵泡≥12个,和/或卵巢体积≥10ml;上述3条中符合2条,并排除其他高雄激素病因:先天性肾上腺皮质增生、库欣综合征、分泌雄激素的肿瘤等。
1.库欣综合征
各种原因导致肾上腺皮质功能亢进。典型表现有满月脸,水牛背,向心性肥胖,皮肤紫纹,多毛,痤疮,高血压以及骨质疏松,糖耐量异常,皮肤色素沉着,多伴有男性化表现。实验室检查显示血浆皮质醇正常的昼夜节律消失,尿游离皮质醇增高。过夜小剂量地塞米松抑制实验是筛选本病的简单方法,如用药后皮质醇下降50%(L),可排除库欣综合征,如皮质醇>390nmol/L,又无引起假阳性的因素存在,则可能是库欣综合征。
2.先天性肾上腺皮质增生(CAH)
属常染色体隐性遗传病。最多见的为先天性21-羟化酶及11β-羟化酶缺乏症。此类患者不能合成糖皮质激素,垂体ACTH失去抑制,肾上腺皮质增生,造成酶前代谢产物——17α-羟孕酮、17α-羟孕烯醇酮及其代谢产物孕三醇堆积,雄激素分泌增多。患者染色体46,XX,性腺为卵巢,内生殖器有子宫及输卵管,但在过多雄激素的作用下外生殖器和第二性征有不同程度的男性化表现,因胎儿期已受过多雄激素影响,故出生时已出现生殖器发育的异常。少数患者为迟发性肾上腺皮质增生,临床表现多延迟到青春期后出现,可表现为缓慢性进行性多毛、月经稀发、无明显生殖器畸形。实验室检查显示血清T和A水平升高(T>2.8nmol/L,A>9.5nmol/L),血清皮质醇水平多正常,17α-羟孕酮升高(>9.1nmol/L),但迟发性患者17α-羟孕酮的基础水平可在正常范围内,但ACTH兴奋试验后其水平显著高于正常,此最具诊断价值。
3.卵巢男性化肿瘤
此类肿瘤包括睾丸母细胞瘤、门细胞瘤、类脂质细胞瘤、颗粒细胞瘤及卵泡膜细胞瘤。多发生于30~50岁之间。患者发病前月经及生育能力正常,发病后出现明显的男性化表现、闭经和不孕。实验室检查雄激素水平升高,主要是T和A升高(T>7nmol/L,A>21nmol/L),且大多数肿瘤分泌雄激素既不受ACTH的调节,也不受促性腺激素的调节。B超是检查此病的较好方法,CT或MRI也可协助诊断。
4.肾上腺肿瘤
肾上腺皮质的良性和恶性肿瘤均可导致雄激素增多,肿瘤的生长和分泌功能为自主性,不受垂体ACTH的控制,也不受外源性糖皮质激素的抑制。对于外源性ACTH的刺激,肾上腺癌一般不反应,腺瘤有时可反应。患者多毛及其男性化表现发展迅速,并伴有糖皮质激素或盐皮质激素分泌过多所致的周身代谢异常。CT或MRI对肾上腺肿瘤很敏感,可定位并显示对侧肾上腺萎缩。
5.卵泡膜细胞增生征
这种病变类似于PCOS,但有所区别。在卵巢间质中,有弥散性的黄素化卵泡膜细胞小岛,分泌过多的雄激素。卵巢卵泡少,原始卵泡由于脂肪性变而退化,故数目较PCOS少。间质增生显著,卵巢更为实性。
6.高泌乳素血症
有研究发现肾上腺细胞膜上有泌乳素受体,泌乳素可刺激肾上腺雄激素的分泌,泌乳素水平升高通常伴有血清DHEA及DHEA-S升高,此症患者肥胖通常是弥漫性肥胖,下半身肥胖多明显。另外约20%的垂体泌乳素腺瘤妇女有多毛症和痤疮。
7.药物因素
主要是雄激素,其次是糖皮质激素或孕激素的长期或大量应用。可出现多毛,表现为女性出现胡须、体毛增多,甚至其他男性化表现。非激素类药物,如苯妥英钠、大仑丁、二氮唑、合成甾体类、达那唑等也可诱发,特点是停药后症状逐渐消失,用药史是诊断的主要依据。
8.中枢神经性因素
某些脑炎、颅外伤、多发性脑脊髓硬化症或松果体肿瘤等疾病,可促使雄激素分泌增多,而出现多毛,通常无其他男性化表现。
9.应激因素
应激时,下丘脑的促肾上腺激素释放激素(CRH)增加,使垂体分泌ACTH增加,对肾上腺皮质产生过度刺激,可出现雄激素增加。
10.妊娠期高雄激素表现
妊娠期大量的绒毛膜促性腺激素可使卵巢有极度的黄素化或刺激门细胞,产生雄激素增加,引起多毛。
11.异位ACTH肿瘤
临床上较少见,是由于肾上腺以外的癌瘤产生有生物活性的ACTH,刺激肾上腺皮质增生。最常见的是肺燕麦细胞癌(约占50%),其次为胸腺瘤和胰腺瘤(各约占10%),其他还有起源于神经脊组织的瘤、甲状腺髓样癌等。
1.药物治疗
目前PCOS的药物治疗已取代手术治疗作为一线治疗方法,治疗的目的主要与患者的生育要求相关。
(1)降低高雄激素血症的药物治疗
1)口服避孕药(OCP) 已作为PCOS妇女的一种传统的可长期应用的治疗方法,主要用于保护子宫内膜、调整月经周期,通过降低卵巢产生的雄激素改善多毛和/或痤疮。OCP可以降低PCOS患者的高雄激素血症。其中应用最多的降低高雄激素血症的OCP是醋酸环丙孕酮,其具有孕激素活性并可与乙炔雌二醇结合发挥抗雄激素作用,它还可与毛囊细胞浆中的双氢睾酮受体结合,阻断雄激素效应向细胞核的传导,通过抑制此受体活性抑制5α还原酶活性,使DHT生成减少、促性腺激素合成减少,促性腺激素水平降低使类固醇合成减少,增加SHBG水平并降低促性腺激素水平。故醋酸环丙孕酮在过去20年中一直被作为PCOS多毛治疗的首选方法,连续6个周期以上的治疗对60%~80%的多毛患者有效。OCP对于无生育要求的PCOS患者是一种简单、经济的治疗方法,但最近的研究显示其可能降低PCOS妇女胰岛素敏感性和糖耐量,另外常见的副作用包括头痛、体重增加、情绪改变、性欲下降、胃肠道反应和乳腺疼痛,应给予注意。
2)糖皮质激素 用于治疗肾上腺合成雄激素过多的高雄激素血症,以地塞米松和强的松的疗效较好,因为它们与受体的亲和力较大,可抑制垂体ACTH分泌,使依赖ACTH的肾上腺雄激素分泌减少。长期应用注意下丘脑-垂体-肾上腺轴抑制的可能性。
3)安体舒通(Spironolactone) 是一种醛固酮类似物,其对酶抑制作用的有效性与醋酸环丙孕酮相似,故两种治疗效果亦相似。同时其具有对抗雄激素作用,其治疗高雄激素血症的作用机理为竞争性与雄激素受体结合,在末梢组织与双氢睾酮(DHT)竞争性结合受体,抑制17α羟化酶,使T、A减少。
4)氟化酰胺(Flutamide) 是一种类固醇复合物,有强效高特异性非类固醇类抗雄激素,没有内在激素或抗促性腺激素作用,不能减少类固醇的合成,但通过受体结合抑制雄激素效应。与醋酸环丙孕酮相比,其治疗后血清雄激素(包括总睾酮和游离睾酮)水平升高,但由于雄激素靶器官效应被拮抗,尽管血清雄激素水平升高,临床表现没有加重。长期大量服用有肝损害可能,另外是否造成胎儿畸形尚无定论,故服药期间应避孕。
(2)促排卵药物治疗
有生育要求的PCOS患者多需要应用促排卵治疗才能妊娠,PCOS的药物促排卵治疗在近50年中有了很大进展,但部分患者应用常规方法疗效较差,故选择合适的方案是促排卵治疗的关键。
1)氯米芬(CC) 1961年Greenblatt报道了应用氯米芬促排卵治疗。CC已经成为PCOS促排卵治疗的首选药物,CC可与下丘脑雌激素受体结合,使中枢神经系统对循环中的雌激素水平的感应被阻滞,脉冲式GnRH和促性腺激素分泌增加,进一步引起卵泡生长和发育。另外,CC也可直接影响垂体和卵巢,分别使促性腺激素分泌增加,协同增强FSH诱导的芳香化酶活性。CC也可在女性生殖道的其他部位表现出抗雌激素特征,特别是子宫内膜和宫颈(使宫颈黏液黏稠)。这些抗雌激素效应对妊娠有负面影响。治疗经常在自然周期月经来后或孕激素撤退出血后开始,即从周期的第2~5天开始,用药5天,开始时间对排卵率、妊娠率和内膜并没有显著影响,在卵泡早期开始可以确保充分的卵泡募集。氯米芬的起始剂量通常是50mg,而100mg则对肥胖妇女更合适。如果以上方法没有排卵反应,下一次剂量可增加50mg直到有排卵,尽管FDA推荐的日最高剂量达250mg,但临床常用的最高剂量是150mg。应尽量采用最小的剂量治疗,因为高剂量并不能改善妊娠结局,并且理论上对内膜厚度和着床有负面影响。如果用B超监测卵泡的成熟,主导卵泡达平均直径18~20mm时就认为是成熟卵泡,对于B超显示卵泡增大但不能排卵者,可用人绒毛膜促性腺激素(hCG)促排卵,指导同房时间。PCOS患者应用CC后排卵率可达80%以上,单独使用妊娠率达30%~60%。用氯米芬两个最明显的副作用是轻度卵巢增大(13.6%)和多胎妊娠,其他副反应包括潮热(10.4%)、腹胀(5.5%)和极少的视觉障碍(1.5%)。部分患者应用CC治疗无效,称为氯米芬抵抗,但目前对氯米芬抵抗的定义不同,最大剂量150~250mg不等,连续应用3个周期,均无排卵反应。
2)促性腺激素(Gn) 对于CC抵抗的患者,促性腺激素(Gn)是常用的促排卵药物,包括FSH及HMG,目前Gn的制剂多样,如hMG、尿FSH和重组FSH,但应用时都存在价格高、多胎妊娠和卵巢过度刺激综合征(OHSS)风险的问题。常规方法月经3~5天起始,每天HMG1支/d或纯FSH75IU/d,排卵率较高,妊娠率较高,但卵巢过渡刺激综合征(OHSS)发生率高,多胎率高。目前多采用小剂量缓增方案,该方法排卵率为70~90%,单卵泡发育率50%~70%,周期妊娠率10~20%,OHSS发生率较低0%~5%,但治疗周期长,患者费用相对高。
3)来曲唑 促排卵治疗是芳香化酶抑制剂(AIs)的一种新的适应证,这类药物以往主要用于乳癌的治疗。它们可以单独应用,也可与FSH联合应用。主要副作用包括胃肠道反应、疲劳、潮热、头和背痛。目前临床常用的芳香化酶抑制剂类药物是来曲唑,主要用于氯米芬抵抗的患者,排卵率达80%,多于月经周期开始后或黄体酮撤退性出血后,月经第3~7天(共5天)应用,之后的监测过程同氯米芬。
(3)胰岛素增敏剂(ISD)治疗
PCOS的一个主要特征是胰岛素抵抗,导致代偿性高胰岛素血症,以便维持正常糖耐量(葡萄糖摄入后胰岛素的正常反应)。在年轻PCOS妇女中,高胰岛素血症是糖耐量异常和后期心脏疾患的主要危险因素。另外,高胰岛素血症还可引起卵巢雄激素合成增加,进而导致无排卵、闭经和不孕。许多PCOS妇女表现为肥胖,由于体重增加胰岛素抵抗更为明显;非肥胖的PCOS妇女(占PCOS的20%~50%)多有腰围/臀围比增加,较正常组亦有更明显的胰岛素抵抗倾向。主要的胰岛素增敏药物有二甲双胍(metformin)、曲格列酮(troglitazone)、罗格列酮(rosiglitazone)、ioglitazone和D-Chiro-Inosito,它们的主要适应证是有胰岛素抵抗、糖耐量受损或2型糖尿病的PCOS妇女。
2.手术治疗
PCOS患者的治疗一直是临床治疗中的难点问题。最早的有效治疗方法是1935年Stein和Leventhal报道的双侧卵巢楔形切除术(BOWR),这种方法开创了手术治疗不孕的时代。手术治疗可以减少卵巢中部分颗粒细胞,卵巢间质产生雄激素减少,从而使循环中的雄激素水平降低,进而GnRH降低,引起血清雄激素浓度进一步降低,这也说明卵巢间质亦受垂体-卵巢轴调控。由于雄激素水平降低,术后大部分患者可恢复自发排卵和月经,有部分可能自然怀孕,但大部分妊娠发生在术后6个月左右。手术治疗根据方法不同分为以下几种:
(1)双侧卵巢楔形切除术(BOWR) 是最早且有效的治疗无排卵性PCOS的方法,手术需要切除1/3的卵巢组织,Stein等报道术后95%的患者能恢复正常月经,妊娠率能达到85%,之后的报道肯定了这一方法的有效性,但成功率差异较大,但此法有多种不良反应,包括手术后粘连形成导致输卵管性不孕,另外还有报道术后卵巢早衰的发生。正因为此种方法损伤较大,现在已很少应用。
(2)腹腔镜下卵巢电灼或激光打孔治疗(LOD) 目前首选的外科手术治疗方法是应用热穿透或激光进行腹腔镜卵巢打孔术,术后促排卵治疗反应改善,由于医疗干预致多胎妊娠率降低,与卵巢楔形切除术相比术后粘连发生率明显降低。主要适用于氯米芬抵抗患者的二线治疗方法,它具有单卵泡率高,避免了多胎及OHSS问题,特别是对于BMI小于29以及游离雄激素指数小于4者治疗效果良好,排卵率80%~90%,妊娠率60%~70%。
(3)经阴道水腹腔镜(THL) 主要用于无明显盆腔原因的不孕症患者输卵管及卵巢结构的检查。通过THL对氯米芬抵抗的PCOS患者进行卵巢打孔治疗,术后6个月累积妊娠率达71%。
3.辅助生育技术
对于应用6个月以上标准的促排卵周期治疗后有排卵但仍未妊娠的PCOS患者,或多种药物促排卵治疗及辅助治疗无排卵并急待妊娠的患者,可以选择胚胎移植的辅助生育技术。
(1)体外受精技术(IIVF) 对于难治性PCOS患者,IVF-ET是一种有效的治疗方法。
(2)卵母细胞体外成熟技术(IVM) 是模拟体内卵母细胞的成熟环境,使从卵巢采集的未成熟卵母细胞在体外达到最后成熟的技术。PCOS患者的高雄激素水平造成其在促排卵过程中易发生卵泡募集过多但成熟障碍的情况,所以,IVM技术为PCOS患者的不孕治疗提供了新的途径。